-
E-MAIL
uscert@naver.com

-
E-MAIL
uscert@naver.com

-
TEL
02-529-8005

-
TEL
02-6226-9776


글로벌 RA 인허가
 HOME > 글로벌 RA 인허가 > 미국
HOME > 글로벌 RA 인허가 > 미국
미국
미국(FDA)에서 정의한 의료기기란
미국에서 의료기기는 FD&C법의 Section 201(h)에서 다음과 같이 정의되어 있습니다.
• [Section 201] (h)
‘의료기기’란 기계, 기구, 도구, 장치, 삽입물, 체외 시약 또는 기타 유사하거나 관련된 물품으로 다음과 같은 모든 부속품 또는 액세서리를 포함한다.
- 1) 공식국가 처방서, 또는 미국 약전, 또는 그 모두에 관한 변경 문서에 기록된 것
- 2) 사용 목적이 인간 또는 기타 동물의 질병, 기타 상태의 진단, 치료, 경감 또는 예방인 것
- 3) 인체 또는 동물의 체내 구조 또는 기능에 영향을 미치는 것으로 체내 화학작용을 통해 주요 목적을 이루지 않고 그 목적 달성을 위해
신진 대사 작용에 영향을 받지 않는 것
• FDA 의료기기 등급 체계 및 인증 진행 방법
미국에서 체외진단용 의료기기의 등급 체계는 의료기기(MDD)와 마찬가지로 안전성 및 유효성 등을 고려한 위험도 수준에 따라 Class I, II, III로 분류합니다.
| 등급 | 의료기기 범위 | 적용규제 | 인증취득 진행방법 |
|---|---|---|---|
| Class I | 보편적으로 다른 장비들보다 설계에 있어서 단순하여 사용자에 대한 위험성이 낮은 저/중등도 위험 의료기기 (전체 의료기기의 약 30%) |
1) 일반규제 2) GMP (해당 시) |
주로 시판 전 등록: Registration |
| Class II | 일반규제(General control)만으로 안전성과 효능을 확인하기에 불충분한 중등도~고위험 의료기기 (전체 의료기기의 약 60-70%) | 1) 일반 및 특별규제 2) GMP (해당 시) |
주로 시판 전 신고: 510(k) |
| Class III | 삽입용/ 이식용 의료기기, 생명 유지용 의료기기와 같이 일반규제와 특별규제로도 안전성과 효능을 확인하기에 불충분한 고위험 의료기기 (전체 의료기기의 10% 미만) | 1) 일반 및 특별규제 2) GMP 3) 임상시험 (해당 시) |
주로 시판 전 승인: PMA |
미국(FDA)에서 요구하는 시설등록(Establishment Registration)
우리나라의 ‘업허가’ 와 비슷한 성격을 가지는 규제 절차이며, 미국 내에 판매 또는 임대를 목적으로 의료기기를 유통하기 위해서 제조원 및 수입원은 [21CFR 807 Subpart B/C]에 해당하는 절차에 따라 의료기기의 생산 및 유통에 관련된 시설을 FDA에 등록해야 합니다.
- - 제조업자 등록에 필요한 정보 : 제조원의 상호명, 주소, 연락처 / 미국 내 US Agent의 상호명, 주소, 연락처 / 미국 내 수입자의 상호명, 주소, 연락처
- - 제조업자 등록을 마친 후, 제품 등록을 하기 전에 해당 제품을 수입하려는 수입업자도 수입업자등록(Initial importer Registration)을 통하여 별도로 등록되어 있어야 합니다.
• FDA Establishment Registration(시설등록) 대상
국내/외 의료기기 제조업체(Manufacturer)
의료기기 포장업체(Re-packer & Re-labeler)
• FDA Establishment Registration(시설등록) 확인사항
의료기기 제조원 시설등록은 시설 및 제품에 대한 승인을 의미하는 것은 아니므로 시설 등록을 완료했다고 하더라도 시설 및 제품에 대한 승인은 따로 진행해야 합니다.
510(k) 또는 PMA를 진행하기 전에 공장 및 시설 등록이 되어 있어야 하지는 않지만, 최소한 기기 판매 30일 전에는 관련 시설들이 등록되어야 합니다.
• FDA Class I Device Registration
Class I 제품은 제품의 위험도가 낮기 때문에 허가가 아닌 등록의 개념입니다. 제조업자 및 수입업자 등록, 제품 등록이 필요하며 FDA에서 규정하는 일반 규제에 따라서 등록하게 됩니다.
• FDA Class I Device Registration 대상
국내/외 Class I 의료기기 제조업체(Manufacturer)
Class I 의료기기 포장업체(Re-packer & Re-labeler)
Class I 의료기기 수입업체(Importer)
• FDA Class I Device Registration 등록 절차

• FDA Class II(510(k)) Device Registration 대상
※ 510(k)허가는 미국으로의 수출을 희망하는 기업에는 필수이며, 이미 FDA 허가를 받은 유사 제품과의 동등성 (SE)이 510(k) 허가에 중요한 판단 요인이 됩니다.
• FDA Class II510(k) 심사 종류
- 1) Traditional : Predicate device와 사용 목적이 동일하고 본질적 동등성에 영향을 주지 않는 선에서 신청자가 제출한 적이 없는 ‘새로운 의료기기’ 가 해당합니다. 분류상 510(k)에 해당하는 경우, 가장 본질적으로 동등한 제품(SE)과 비교하여 진행합니다.
- 2) Special : Predicate device와 사용 목적이 동일하고 본질적 동등성에 영향을 주지 않는 선에서 기기에 변경이 있는 경우 적용 가능하며, 변경사항이 중대한 안전이나 유효성에 문제가 없는 ‘설계’ 또는 ‘부품 변경’ 인 경우에만 해당됩니다. 기존 Traditional 510(k)와 동일한 포맷으로 진행하나 변경된 부분을 중점적으로 평가 및 심사 작업 등이 진행되기 때문에 비교적 신속하게 진행됩니다.
- 3) Abbreviated : 안내지침서 및 특별 규제 요건이 존재하는 경우 혹은 FDA에 의하여 관련 인정기준에 적합하다는 것을 인정받은 경우 진행 가능한 절차이며 평가 및 심사 작업 등이 신속하게 진행됩니다
• FDA Establishment Registration(시설등록) 확인사항
• FDA Class II(510(k)) Device Registration 대상
• FDA Class I Device Registration 등록 절차
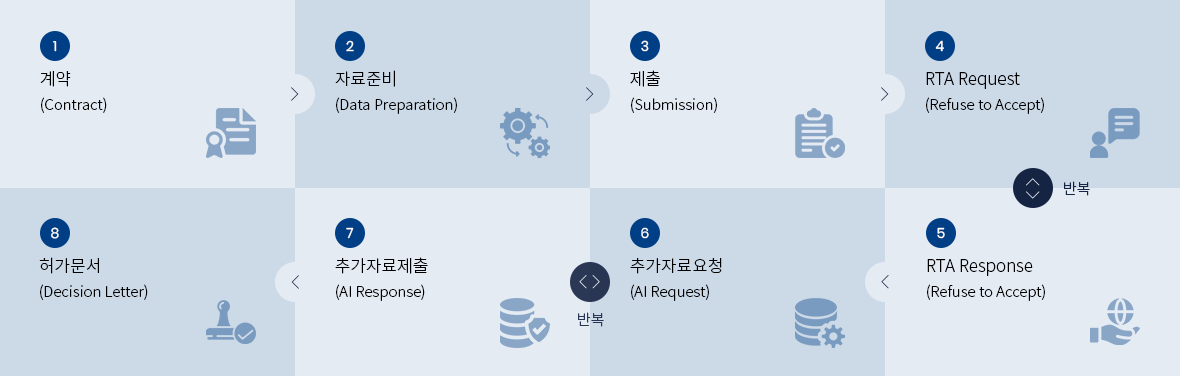
• FDA Class III(PMA) Device Registration


 KOR
KOR  ENG
ENG  JPN
JPN  CHN
CHN 






